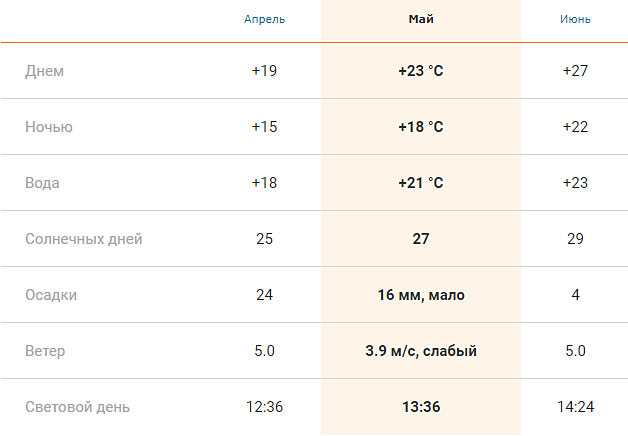
Погода в Ираклионе сегодня, прогноз погоды Ираклион на сегодня, о. Крит, Греция
GISMETEO: Погода в Ираклионе сегодня, прогноз погоды Ираклион на сегодня, о. Крит, ГрецияПерейти на мобильную версию
Сейчас
16:22
+20,4 69
По ощущению +20 68
Ср, 2 нояб
Сегодня
+1457
+2272
Чт, 3 нояб
Завтра
+1864
+2373
200
500
800
1100
1400
1700
2000
2300
+1457
+1559
+1864
+2170
+2272
+2068
+1966
+1966
Скорость ветра, м/cкм/ч
2-4 7-14
2-4 7-14
4-7 14-25
7-8 25-29
7-9 25-32
3-5 11-18
2-5 7-18
2-6 7-22
Осадки, мм
Распечатать. ..
..
Ветер, м/скм/ч
Ср, 2 нояб, сегодня
Чт, 3
200
500
800
1100
1400
1700
2000
2300
Порывы
Пыльца, баллы
Ср, 2 нояб, сегодня
Чт, 3
200
500
800
1100
1400
1700
2000
2300
Злаковые травы
Амброзия
Погода на дорогах
Ср, 2 нояб, сегодня
Чт, 3
200
500
800
1100
1400
1700
2000
2300
Сухая дорога
Сухая дорога
Сухая дорога
Сухая дорога
Сухая дорога
Сухая дорога
Сухая дорога
Партнерские Новости · АвтоДавление, мм рт.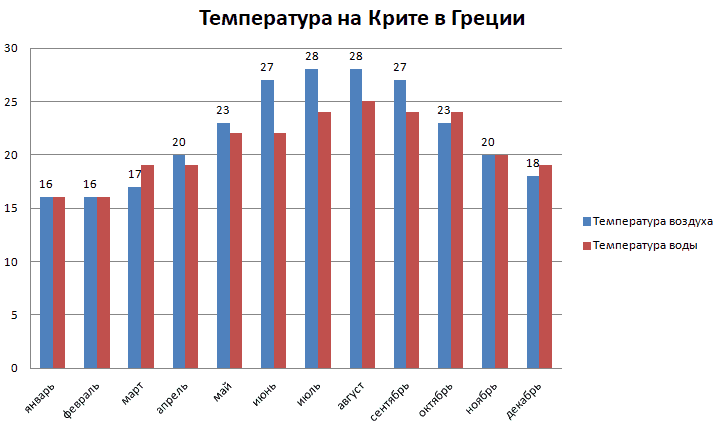 ст.гПа
ст.гПа
Ср, 2 нояб, сегодня
Чт, 3
200
500
800
1100
1400
1700
2000
2300
7621016
7621016
7621016
7621016
7611014
7631017
7631017
7631017
Влажность, %
Ср, 2 нояб, сегодня
Чт, 3
200
500
800
1100
1400
1700
2000
2300
87
89
81
67
71
68
69
65
Солнце и Луна
Ср, 2 нояб, сегодня
Чт, 3
Долгота дня: 10 ч 42 мин
Восход — 6:41
Заход — 17:23
Сегодня день на 2 минуты короче, чем вчера
Луна растущая, 63%
Восход — 13:48 (1 ноября)
Заход — 0:00
Полнолуние — 8 ноября, через 6 дней
Геомагнитная активность, Кп-индекс
Ср, 2 нояб, сегодня
Чт, 3
200
500
800
1100
1400
1700
2000
2300
Осадки
Температура
Ветер
Облачность
Неа-Аликарнассос
Ираклион Никос Казандзакис
Гази
Арханес
Тилиссос
Эпископи (Ираклион)
Пеза
Профитис Илиас
Гувес
Айос-Миронас
Венерато
Крусонас
Като Аситес
Трапсано
Кастели
Аркалохори
Аногея
Ая Варвара
Гергери
Зониана
Малия
Зарос
Гаразо
Асими
Погода в Ираклионе на 10 дней, прогноз погоды Ираклион на 10 дней, о.
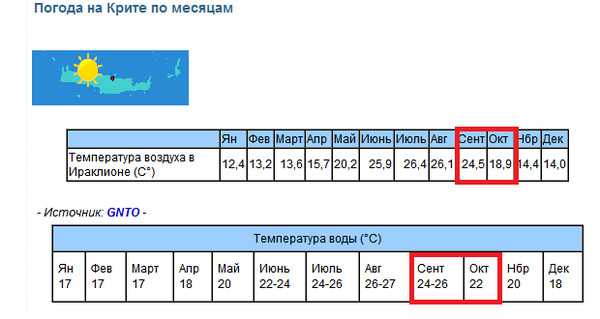 Крит, Греция.GISMETEO: Погода в Ираклионе на 10 дней, прогноз погоды Ираклион на 10 дней, о. Крит, Греция.
Крит, Греция.GISMETEO: Погода в Ираклионе на 10 дней, прогноз погоды Ираклион на 10 дней, о. Крит, Греция.Перейти на мобильную версию
Ср
2 нояб
Чт
3
Пт
4
Сб
5
Вс
6
Пн
7
Вт
8
Ср
9
Чт
10
Пт
11
+2272
+1457
+2373
+1864
+2475
+1966
+2373
+1864
+2475
+1864
+2068
+1763
+1763
+1661
+1763
+1661
+1864
+1559
+1966
+1457
Максимальная скорость ветра, м/cкм/ч
Осадки, мм
Распечатать…
Среднесуточная температура
Ср
2 нояб
Чт
3
Пт
4
Сб
5
Вс
6
Пн
7
Вт
8
Ср
9
Чт
10
Пт
11
+1864
+2068
+2170
+2068
+2068
+1864
+1661
+1661
+1661
+1661
Ветер, м/скм/ч
Ср
2 нояб
Чт
3
Пт
4
Сб
5
Вс
6
Пн
7
Вт
8
Ср
9
Чт
10
Пт
11
Максимальная скорость ветра, м/cкм/ч
Пыльца, баллы
Ср
2 нояб
Чт
3
Пт
4
Сб
5
Вс
6
Пн
7
Вт
8
Ср
9
Чт
10
Пт
11
Злаковые травы
Амброзия
Погода на дорогах
Ср
2 нояб
Чт
3
Пт
4
Сб
5
Вс
6
Пн
7
Вт
8
Ср
9
Чт
10
Пт
11
Сухая дорога
Сухая дорога
Сухая дорога
Влажная дорога
Влажная дорога
Влажная дорога
Сухая дорога
Давление, мм рт. ст.гПа
ст.гПа
Ср
2 нояб
Чт
3
Пт
4
Сб
5
Вс
6
Пн
7
Вт
8
Ср
9
Чт
10
Пт
11
7631017
7611014
7631017
7611014
7611014
7591012
7601013
7581010
7591012
7571009
7591012
7571009
7621016
7591012
7641018
7621016
7641018
7631017
7641018
7621016
Влажность, %
Ср
2 нояб
Чт
3
Пт
4
Сб
5
Вс
6
Пн
7
Вт
8
Ср
9
Чт
10
Пт
11
75
57
47
62
65
77
79
67
64
68
Геомагнитная активность, Кп-индекс
Ср
2 нояб
Чт
3
Пт
4
Сб
5
Вс
6
Пн
7
Вт
8
Ср
9
Чт
10
Пт
11
Осадки
Температура
Ветер
Облачность
Неа-Аликарнассос
Ираклион Никос Казандзакис
Гази
Арханес
Тилиссос
Эпископи (Ираклион)
Пеза
Профитис Илиас
Гувес
Айос-Миронас
Венерато
Крусонас
Като Аситес
Трапсано
Кастели
Аркалохори
Аногея
Ая Варвара
Гергери
Зониана
Малия
Зарос
Гаразо
Асими
Критические температуры и давления для некоторых распространенных веществ
Газы могут быть преобразованы в жидкости путем сжатия газа при подходящей температуре.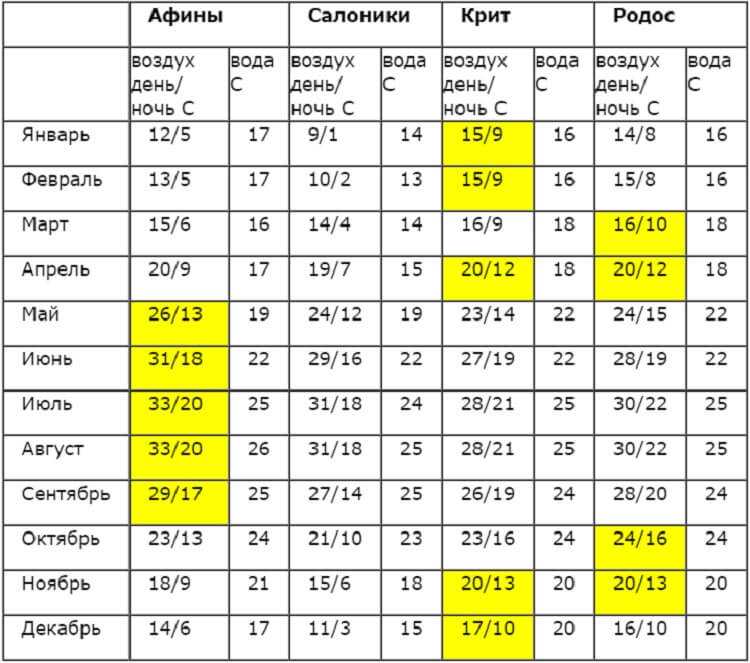 Однако с повышением температуры их становится труднее сжижать, поскольку кинетическая энергия частиц, из которых состоит газ, также увеличивается. При критической температуре они уже не могут переходить в жидкое состояние.
Однако с повышением температуры их становится труднее сжижать, поскольку кинетическая энергия частиц, из которых состоит газ, также увеличивается. При критической температуре они уже не могут переходить в жидкое состояние.
- Критическая температура: Температура, выше которой вещество не может существовать в виде жидкости, независимо от силы нажатия. Каждое вещество имеет критическую температуру.
- Критическое давление: Давление, необходимое для сжижения пара вещества при его критической температуре
- Критическая точка: Конечная точка кривой давления-температуры, обозначающая условия, при которых жидкость и ее пар могут сосуществовать. При более высоких температурах газ не может быть сжижен одним только давлением. В критической точке, определяемой критической температурой T c и критическое давление p c фазовые границы исчезают.
- Тройная точка: Температура и давление, при которых три фазы (газ, жидкость и твердое вещество) сосуществуют в термодинамическом равновесии.

В таблице ниже показаны критические температура и давление для некоторых распространенных веществ, а также температура кипения.
См. Тройная точка для списка значений тройной точки для обычных веществ.
| вещество | Критическая температура | Критическое давление | Температура кипения (1 атм) | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| [° F] | [° C] | [° F] | [° C] | [° F] | [° C] | [° F] | [° C]. ] | [bar] | [°F] | [°C] | ||||||
| Air | -220.94 | -140.52 | 549.08 | 37.858 | — | — | ||||||||||
| Ammonia (NH 3 ) | 270 | 132.4 | 1636 | 112.8 | -27.4 | -33 | ||||||||||
| Argon | -188 | -122 | 705. 6 6 | 48.7 | — 302.5 | -185.8 | ||||||||||
| Butane | 305.6 | 152 | 550.4 | 38 | 32 | 0 | ||||||||||
| Carbon-dioxide (CO 2 ) | 87.8 | 31.2 | 1071.6 | 73.8 | -110 | -79 | ||||||||||
| Carbon-monoxide (CO) | -220.5 | -140.3 | 507.5 | 35 | -310 | -190 | ||||||||||
| Chlorine | 291 | 144 | 1118.7 | 77.1 | -29.3 | -34 | ||||||||||
| Decane | 653 | 345 | 301.7 | 20.8 | 345 | 174 | ||||||||||
| Dowtherm A | 465 | 32.1 | ||||||||||||||
| Ethane | 90.0 | 32.2 | 708 | 48. 9 9 | -127.4 | -88,5 | ||||||||||
| этанол (спирт) | 467 | 242 | 914 | 63 | 173 | 78,4 | 173 | 78,4 | 173 | 78,4 | 173 | 78,4 | 173 | 78,4 | 0048||
| Ethylether | 381 | 194 | 522 | 36 | 94.2 | 34.6 | ||||||||||
| Ethylene | 48.9 | 9.4 | 735 | 50.7 | -272.6 | -169.2 | ||||||||||
| фтор | -200 | -129 | 808,5 | 55,8 | -307 | -188 | ||||||||||
| Гелиус | -466 | |||||||||||||||
| Helium | -46669. | |||||||||||||||
| -46669. | ||||||||||||||||
| .0069 -271 | 33.2 | 2.3 | -452 | -269 | ||||||||||||
| Hydrogen (H) | -400 | -240 | 188. 2 2 | 13.0 | -423 | -253 | ||||||||||
| Hydrogen Chloride | 125 | 51.6 | 1198 | 82.7 | -121.1 | -85.1 | ||||||||||
| Isobutane | 274 | 135 | 529.2 | 36.5 | 10.9 | -11.7 | ||||||||||
| Isobutylene | 293 | 145 | 580 | 40.0 | 19.6 | -6.9 | ||||||||||
| Isononane | 590 | 310 | 335.1 | 23.1 | 303 | 151 | ||||||||||
| Метан | -117 | -82.6 | 673.3 | 46,5 | -259 | -169 -169 46,5 | -259 | -169 -169 -169 46,5 | -259 | -169 -169 46,5 | -259 | -169 46,5 | -259 | 46,5 | -259 | 46,5 | .0070
| Nitrogen (N) | -232. 6 6 | -147 | 492.4 | 34.0 | -321 | -195 | ||||||||||
| Nitrous Oxide (N 2 O) | 97.4 | 36.4 | 1047,6 | 72,3 | -127 | -88,5 | ||||||||||
| .-183 | ||||||||||||||||
| Phosgene | 823.2 | 56.8 | 46.9 | 8.3 | ||||||||||||
| Propane | 206.1 | 96.7 | 617.4 | 42.6 | -44 | -42 | ||||||||||
| Пропилбензол | 689 | 365 | 464.2 | 32 | 319 | 159 | ||||||||||
| Propilene | 198 | |||||||||||||||
| 198 | ||||||||||||||||
| 198 | ||||||||||||||||
| 0069 92.4 | 670.3 | 46.3 | -54 | -48 | ||||||||||||
| Refrigerants | ||||||||||||||||
| Undecane | 691 | 366 | 287.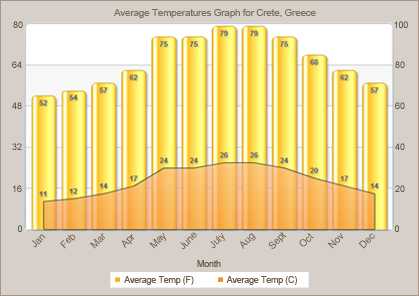 2 2 | 19.8 | 385 | 196 | ||||||||||
| Вода | 705 | 374 | 3206.2 | 220,5 | 212 | 100 | ||||||||||
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 49667
- Эд Витц, Джон В. Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан
- Электронная библиотека химического образования (ChemEd DL)
Предположим, мы запечатываем чистую жидкость и ее пар в прочную стеклянную трубку и нагреваем ее до очень высокой температуры. При повышении температуры давление пара будет расти. (Не рекомендуется нагревать жидкость таким образом, если вы не уверены, что контейнер выдержит повышенное давление.) Повышение давления пара соответствует большему количеству молекул в ограниченном объеме паровой фазы. Другими словами, пар становится значительно более плотным. В конце концов мы достигаем температуры, при которой плотность пара становится такой же, как плотность жидкости. Так как жидкости обычно отличаются от газов по плотности, то теперь и те, и другие стали идентичными. Температура, при которой это происходит, называется
При повышении температуры давление пара будет расти. (Не рекомендуется нагревать жидкость таким образом, если вы не уверены, что контейнер выдержит повышенное давление.) Повышение давления пара соответствует большему количеству молекул в ограниченном объеме паровой фазы. Другими словами, пар становится значительно более плотным. В конце концов мы достигаем температуры, при которой плотность пара становится такой же, как плотность жидкости. Так как жидкости обычно отличаются от газов по плотности, то теперь и те, и другие стали идентичными. Температура, при которой это происходит, называется
Прилагаемые видеоролики иллюстрируют, что происходит экспериментально в случае хлора. На первом видео, когда температура приближается к критической, жидкость и пар становятся очень похожими по внешнему виду, и мениск между ними становится трудно различить. Наконец, при критической температуре мениск полностью исчезает. Выше критической температуры образец достаточно однороден, и трудно сказать, называть его жидкостью или газом.
Выше критической температуры образец достаточно однороден, и трудно сказать, называть его жидкостью или газом.
Во второй половине видео колба снова доводится до критической температуры. Скорость молекул газа уменьшается до точки, при которой межмолекулярные силы могут вызвать конденсацию жидкой фазы. Снова появляется мениск, и хлор снова разделяется на жидкую и паровую фазы.
Как только газ превысит свою критическую температуру, невозможно заставить его разделиться на слой жидкости внизу и слой пара вверху, независимо от того, насколько велико давление, как это видно на графике ниже. На графике видно, что когда температура превышает 300 К, невозможно вернуться в жидкую форму. Повышение давления приводит только к переходу от газа к сверхкритическому флюиду.
Кислород, например, имеет температуру намного выше своей критической температуры при комнатной температуре.
В следующей таблице перечислены критические температуры и критические давления для некоторых хорошо известных газов и жидкостей. Такие данные часто весьма полезны. Многие газы коммерчески продаются в прочных стальных баллонах под высоким давлением. Поведение газа в таком цилиндре зависит от того, находится ли он выше или ниже критической температуры. Критическая температура пропана, например, составляет 97°C, что намного выше комнатной температуры. Так, пропан в баллоне высокого давления состоит из смеси жидкости и пара, и иногда можно услышать, как внутри плещется жидкость.
Таблица \(\PageIndex{1}\) Критические температуры и давления некоторых простых веществ.
| Имя | Критическая температура (К) | Критическое давление (МПа) | Критическое давление (атм) |
|---|---|---|---|
| Водород (Н) | 1,30 | 12,8 | |
| Неон (Ne) | 44,5 | 2,7 | 26,9 |
| Азот (N) | 126,0 | 3,39 | 33,5 |
| Двуокись углерода (CO 2 ) | 304,2 | 7,39 | 73,0 |
| Пропан (C 3 H 8 ) | 370 | 4,23 | 41,8 |
| Аммиак (NH 3 ) | 405,5 | 11,29 | 111,5 |
| Вода (H 2 O) | 647. 1 1 | 22.03 | 217,5 |
Давление газа в таком баллоне будет равно давлению паров пропана, а именно 9,53 атм (965,4 кПа). Пока в баллоне остается немного жидкости, давление будет оставаться на уровне 9,53 атм. Только когда вся жидкость испарится, давление начнет падать. В этот момент цилиндр будет практически пуст. Совсем другое поведение наблюдается в случае баллона с кислородом. Поскольку температура кислорода выше его критической температуры при 20°C, цилиндр будет содержать однородную жидкость, а не смесь жидкости и пара. По мере того, как мы израсходуем кислород, давление будет постепенно снижаться до 1 атм, после чего O
Принципы, рассмотренные в предыдущем абзаце, применимы к аэрозольным баллончикам, с которыми большинство из нас сталкивается каждый день. Такие аэрозольные баллончики содержат небольшое количество активного ингредиента — кондиционера для волос, дезодоранта, крема для бритья и т.
Когда клапан открыт, давление паров жидкого пропеллента заставляет активный ингредиент и пропеллент выбрасываться из баллончика. Пока остается жидкое топливо, давление внутри баллончика будет постоянным (это будет давление пара), а распыление будет воспроизводимым. Должно быть очевидно, почему на таких банках всегда имеется предупреждение о том, что их нельзя бросать в огонь: давление паров увеличивается быстрее при более высоких температурах, и, таким образом, нагревание закрытой жидкости с гораздо большей вероятностью приведет к взрыву, чем нагревание одного газа. (Последний случай был описан в предыдущем примере.)
Эта страница под названием 10.13: Критическая температура и давление распространяется под лицензией CC BY-NC-SA 4.